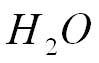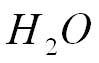1
. Principe
16
Masse atomique ( la valeur la plus grande)
8
Numéro atomique --> Nb d’électrons
2 atomes d’hydrogène + 1 atome
d’oxygène
( 2 x 1 ) + ( 1 x 16)
2 + 16
18 g/môle
Considérons
la formule de la molécule d'eau.
Calculons
sa masse molaire.
C'est
faire la somme des masses de tous les atomes présents dans une molécule
2. Exercices.
- 2.1 Calcule la masse molaire du chlorure de sodium
- 2.2 Calcule la masse molaire du sulfate d'hydrogène ou acide sulfurique.
Le
tableau des valeurs périodiques nous donne les valeurs suivantes pour
l'hydrogène et l'oxygène.
Correction :
( 1 x 23 ) + ( 1 x 35 )
58 g/môle
( 2 x 1) + ( 1 x 32 ) + ( 4 x 16 )
98 g/môle
Attention; il ne faut
pas se tromper avec le numéro atomique. Prenez bien la masse qui est
la plus grande valeur des deux.
La
masse molaire moléculaire
Mais
qu'est ce qu'une mole ?